| Indice | indietro | avanti |
Spettroscopia dei gas
Spettro continuo di emissione
La radiazione emessa dai corpi incandescenti può essere osservata tramite uno spettroscopio. Lo spettroscopio è uno strumento composto essenzialmente da un prisma simile a quello con cui Newton analizzò i colori della luce bianca. Attraverso il prisma è possibile scomporre la luce emessa nelle diverse lunghezze d'onda, analizzandone la parte visibile. Se il corpo è solido lo spettro di emissione è continuo, cioè comprende tutti i colori del visibile.
Spettro di emissione dei gas
Un gas emette luce se è portato all'incandescenza per esempio attraverso una forte scarica elettrica. Lo spettro di emissione dei gas si presenta però come uno spettro a righe (righe colorate su fondo nero) formato da pochi colori di lunghezza d'onda abbastanza precisa. Ogni gas ha uno spettro caratteristico, così che si può riconoscere il gas mediante l'analisi spettrometrica.
Righe spettrali su Physics 2000
Spettro di assorbimento dei gas
Se si frappone del gas tra un solido incandescente che emette uno spettro continuo di radiazioni, si osserva che il gas assorbe solo le lunghezze d'onda del proprio spettro caratteristico. Uno spettro di assorbimento è pertanto il negativo dello spettro di emissione (righe nere su fondo colorato).
Lo spettro dell'idrogeno ha un'importanza storica perché la sua analisi ha permesso di indagare più a fondo sul modello atomico. Le prime righe osservate dello spettro dell'idrogeno furono quelle che cadevano nell'intervallo della luce visibile: nel 1885 lo svizzero Johann Balmer riuscì a scrivere una formula empirica con la quale ricavare le diverse lunghezze d'onda λ osservate sperimentalmente.

La costante Rh = 1,0974 107 m-1 si chiama costante di Rydberg per l'idrogeno. Il numero di riga nr vale 3, 4, 5... e identifica le diverse righe di emissione, una per ogni colore.
La formula empirica di Balmer non si limitò a descrivere una situazione già nota, ma permise di prevedere teoricamente, con una semplice generalizzazione, l'esistenza, nello spettro dell'idrogeno, di serie di righe non visibili che furono osservate successivamente nel campo dell'infrarosso e dell'ultravioletto..
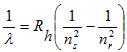
Il numero di serie ns è un numero intero che identifica la particolare serie. (Per la serie di Balmer ns = 2). Il numero di riga nr è un intero sempre maggiore di ns e identifica una particolare riga all'interno di una serie.
Serie spettrali dell'idrogeno
| nr | Nome della serie | Regione dello spettro |
| 1 | Lyman | Ultravioletto |
| 2 | Balmer | Visibile |
| 3 | Paschen | Infrarosso |
| 4 | Brackett | Infrarosso |
Per ogni serie le righe si addensano verso una lunghezza d'onda che costituisce il limite inferiore della serie. Appare misterioso, alla luce dei modelli atomici classici, come un atomo semplice come quello di idrogeno, dotato di un solo elettrone, riesca a produrre uno spetto così complesso. Questa regola empirica che determinava le lungheze d'onda dello spettro dell'idrogeno toccava quindi qualche legge naturale più profonda che la fisica classica non era in grado di spiegare.
| Indice | indietro | avanti |
Copyleft Ludovica Battista