| Indice | indietro | avanti |
Entropia

Per distinguere i processi irreversibili da quelli reversibili viene introdotta una nuova grandezza di stato chiamata entropia per la quale non valgono leggi di conservazione: L'entropia è una grandezza che non si conserva.
Come per tutte le grandezze di stato, la variazione ΔS di entropia è nulla per un gas che compie una trasformazione ciclica e dipende solo dallo stato iniziale e da quello finale per una trasformazione aperta.
Dal punto di vista microscopico, come vedremo, l'entropia è collegata con il grado di disordine delle particelle del sistema, dal punto di vista macroscopico il concetto di entropia è meno intuibile. Per semplicità consideriamo una trasformazione reversibile a temperatura costante:
Si definisce variazione di entropia ΔS in una trasformazione isoterma il rapporto tra il calore scambiato Q e la temperatura T cui avviene lo scambio
ΔS = Q /T
L'entropia si misura in J/K
La temperatura è espressa in gradi Kelvin ed è quindi sempre positiva, il calore Q può essere invece positivo o negativo: ne segue che l'entropia di un sistema aumenta se il calore è assorbito, diminuisce se il calore è ceduto.
| Stato del gas | volume | pressione | temperatura |
| A | VA = 10 dm3 | PA = 100 kPa | T = 300 K |
| B | VB = 2 VA | PB = PA/2 | T = 300 K |
Il gas acquista calore e pertanto aumenta la sua entropia di una quantità:
ΔSgas = Q / T = n R ln (VB / VA) con n numero di moli, R costante dei gas perfetti
Facendo i calcoli otteniamo ΔSgas = 2,31 J/K
Non possiamo affermare che l'entropia dell'Universo è aumentata, perchè durante la trasformazione isoterma il gas non è rimasto isolato, ma ha scambiato calore con l'ambiente esterno: per determinare la variazione di entropia dell'Universo occorre calcolare anche la variazione di entropia dell'ambiente.
L'ambiente è una sorgente di calore che si mantiene sempre a temperatura T: poiché esso cede calore al gas nell'espansione, la variazione di entropia dell'ambiente è uguale e contraria a quella del gas.
ΔSambiente = -2,31 J/K
Se ampliamo il sistema gas, includendo in esso anche l'ambiente esterno, otteniamo un sistema chiuso in cui gli scambi energetici avvengono tra diverse parti dell'ambiente.
| Sistema | Variazione di entropia (J/K) |
| GAS | ΔSgas = 2,31 |
| AMBIENTE | ΔSambiente = -2,31 |
| UNIVERSO | ΔS = 0 |

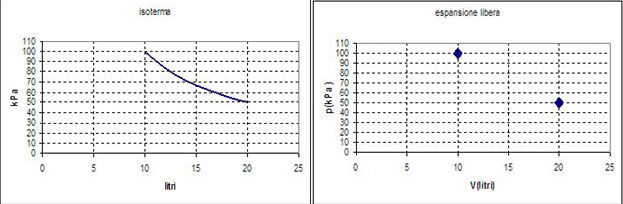
Essendo l'entropia una funzione di stato, essa dipende solo dagli stati iniziale e finale e non dalla particolare trasformazione, quindi, pur avendo definito ΔSgas solo per una isoterma reversibile, la variazione di entropia tra gli stati A e B è sempre, con qualunque percorso: ΔSgas = 2,31 J/K
Questa volta però non c'è stata interazione con l'ambiente esterno ed esso non ha subito variazioni entropiche.
| Sistema | Variazione di entropia (J/K) |
| GAS | ΔSgas = 2,31 |
| AMBIENTE | ΔSambiente = 0 |
| UNIVERSO | ΔS = 2,31 |
Alla fine di una espansione libera (irreversibile), l'entropia dell'Universo è aumentata.
| Indice | indietro | avanti |
Copyleft Ludovica Battista