| Indice | indietro | avanti |
Teoria cinetica dei gas 2
Vediamo ora come le grandezze macroscopiche del gas siano tutte collegate alla velocità quadratica media.
Riassumiamo in uno schema alcuni simboli di grandezze importanti nella teoria cinetica dei gas.
Alcune costanti
| simbolo | significato | valore |
| NA | numero di Avogadro | 6,02 1023 mol-1 |
| R | costante dei gas perfetti | 8,31 J mol-1K-1 |
| k | costante di Boltzmann = R / NA | 1,38 10-23J/K |
La costante di Boltzmann, è direttamente legata alla costante R dei gas e al numero di Avogadro. Essa ha un ordine di grandezza molto piccolo ed è una costante fondamentale a livello microscopico.
Alcune variabili
| simbolo | significato | unità di misura |
| n | numero di moli | mol |
| N | numero di molecole | - |
| m | massa di una molecola | g oppure u = 1,66 10-24 g |
| M | massa di una mole | g mol-1 |
| vqm | velocità quadratica media del gas | m s-1 |
Si può notare che nella teoria cinetica le masse vengono storicamente misurate in grammi (e non in kg). Bisogna fare attenzione a questo particolare!
Ricordando che in una mole ci sono NA particelle, si hanno le seguenti relazioni base:
numero di molecole in un gas N = n NA
massa di una mole (massa molare) M = m NA

Velocità quadratica media, pressione e temperatura di un gas
La pressione che un gas esercita contro le pareti del recipiente che lo contiene si spiega, a livello microscopico, con il grande numero di urti che le particelle fanno contro le pareti.
Consideriamo che siano soddisfatte le seguenti condizioni:
- N molecole di un gas di massa molare M contenute in una scatola di volume V
- Le particelle si muovono a caso nella scatola
- Le dimensioni delle particelle sono così piccole da rendere trascurabile la probabilità di avere urti tra di loro.
- Le particelle urtano elasticamente contro le pareti, conservando quindi la loro energia cinetica.
Con queste condizioni, tipiche di un gas perfetto, si dimostra, utilizzando le leggi della dinamica, che:
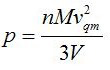
Questa relazione collega la velocità quadratica media delle particelle (grandezza microscopica) alle grandezze macroscopiche del gas.
Confrontando questa espressione con la legge di stato di gas perfetti
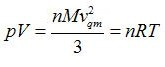
si ottiene la seguente imprtante relazione:
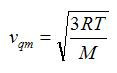
Come si vede, la velocità quadratica media è proporzionale alla radice della temperatura T (oppure la temperatura T è proporzionale al quadrato della velocità quadratica media).
Se ad esempio un gas viene riscaldato in modo da quadruplicare la sua temperatura, dal punto di vista microscopico avviene che la velocità media delle molecole raddoppia.
Attenzione! La temperatura è una grandezza macroscopica: se ci riferiamo ad una particella, non possiamo dire che essa è calda o fredda, ma solo che è veloce o lenta.
| Indice | indietro | avanti |
Copyleft Ludovica Battista