| Indice | indietro | avanti |
Problemi sul secondo principio della termodinamica
1) Variazione di entropia in una trasformazione qualunque
Abbiamo definito la variazione di entropia ΔS solo per trasformazioni a temperatura costante.
Nelle trasformazioni gli scambi di calore avvengono in genere mentre la temperatura varia durante tutto il processo fino al raggiungimento del valore finale: in una dilatazione isobara, per esempio, la temperatura aumenta proporzionalmente al volume e non è possibile calcolare la variazione di entropia semplicemente come rapporto calore/temperatura.
In questo caso bisognerebbe suddividere la trasformazione (reversibile) in una serie di trasformazioni infinitesime in ognuna delle quali viene scambiata una quantità infinitesima dQ di calore ad un certo valore (finito) della temperatura. La variazione di entropia è data dalla somma integrale di tutti questi termini, ma il calcolo richiede appunto la conoscenza dell'analisi infinitesimale.
Esiste però un metodo un più semplice per calcolare la variazione di entropia in una trasformazione qualunque, considerando che l'entropia, come l'energia interna, è una funzione di stato la cui variazione dipende solo dallo stato iniziale e da quello finale.
- isoterma e isocora
- isoterma e isobara
- isoterma e adiabatica
- isocora e adiabatica
Una trasformazione adiabatica avviene senza scambi di calore tra sistema e ambiente. Ne consegue che la variazione di entropia è nulla. Mentre le altre grandezze di stato variano tutte (volume, pressione, temperatura e energia interna), l'entropia rimane costante.
La variazione ΔS di entropia durante una trasformazione da uno stato A ad uno stato B è quella che si ottiene con una qualunque trasformazione reversibile che porta da A a B. In particolare possiamo seguire un percorso formato da una isoterma AC e una adiabatica CB (o viceversa)
dove n è il numero di moli, R la costante dei gas, VA il volume iniziale e VC è il volume dello stato intermedio che va determinato.
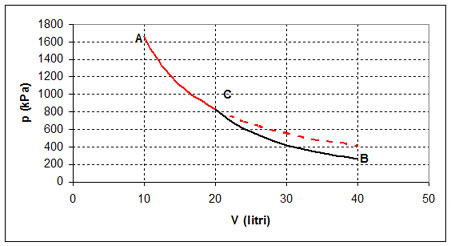
Nel diagramma raffigurato gli stati iniziale e finale A e B di un gas non sono collegati da una isoterma: bisogna individuare uno stato intermedio C in modo che sia AC una isoterma (linea rossa) e CB una adiabatica (linea nera). La variazione di entropia si calcola solo per la trasformazione AC
Nella trasformazione rappresentata nel diagramma si ha:
| Stato A | Stato B |
| VA = 10 dm3 | VB = 40 dm3 |
| pA = 1662 kPa | pB = 262 kPa |
| TA = 1000 K |
Con l'equazione delle adiabatiche pC VCγ = pB VBγ e quella dei gas perfetti pC VC = pA VA si determina il volume nello stato intermedio C
da cui VC = 20 dm3
e quindi ΔS = 11,5 J/K
2) Variazione di entropia nella fusione del ghiaccio
Analizziamo una trasformazione irreversibile in cui il calcolo della variazione entropica è semplice: la fusione di un blocco di ghiaccio.
- SI
- NO
| Dati | Richieste | |
| m = 0,1 kg | massa del ghiaccio | ΔS |
| T = 0ºC = 273 K | temperatura di fusione | |
| QL = 333 kJ kg-1 | calore latente di fusione per il ghiaccio |
L'acqua passa dallo stato solido a quello liquido acquistando dall'ambiente una quantità
di calore
Q = m QL = 33,3 kJ
Alla fine del processo l'entropia dell'acqua allo stato liquido è aumentata di
una quantità
ΔS = Q / T = 33,3 kJ / 273 K = 0,12 kJ / K
L'ambiente perde una quantità di entropia minore perchè la sua temperatura è maggiore di 273 K
3) Variazione di entropia in un ciclo

Poichè l'entropia è una funzione di stato del sistema, la variazione di entropia del sistema alla fine di un ciclo qualsiasi è sempre nulla.
ΔSsistema = 0
Cosa accade all'ambiente al termine di una trasformazione ciclica?
Se Q1 e Q2 sono, in valore assoluto, gli scambi termici tra il sistema e l'ambiente rispettivamente alla temperatura T1 ed alla temperatura T2 (con T1 > T2), allora l'ambiente
- perde una quantità di entropia ΔS1ambiente = Q1 / T1
- acquista una quantità di entropia ΔS2ambiente = Q2 / T2
Se queste due variazioni sono uguali in valore assoluto, l'ambiente non varia il suo grado di entropia e di conseguenza l'entropia dell'Universo rimane immutata.
Ricordiamo che in una macchina ideale e reversibile si ha il massimo rendimento teorico e quindi:
(Q1 - Q2) / Q1 ≤ (T1 - T2) / T1 (dove il segno uguale vale solo per trasformazioni reversibili)
quindi 1 - Q2 / Q1 ≤ 1 - T2 / T1
e, con semplici passaggi, Q2 / T2 ≥ Q1 / T1 (entropia acquistata ≥ entropia perduta)
| Indice | indietro | avanti |
Copyleft Ludovica Battista