| Indice | indietro | avanti |
Problemi di sul primo principio della termodinamica
1) Una trasformazione qualunque
| Stato del gas | volume | pressione | temperatura |
| A | VA = 50 dm3 | PA = 80 kPa | TA = 500 K |
| B | VB = 150 dm3 | PB = 20 kPa | TB = 300 K |
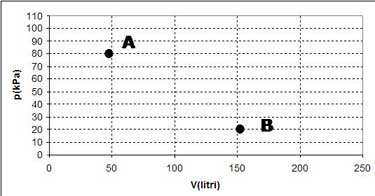
La trasformazione non è di quelle conosciute e, per quanto ne sappiamo, potrebbe anche essere irreversibile. Non è quindi possibile determinare il calore e il lavoro scambiati. Ma, mentre il calore e il lavoro dipendono dal particolare percorso seguito, la variazione ΔU di energia interna, dipende unicamente dallo stato iniziale e da quello finale e può essere calcolata conoscendo solo la temperatura iniziale e finale del gas.
Con un gas monoatomico, si ha:
ΔU = 3/2 n R (TB - TA) = -2400 J
Il numero n di moli (n = 0,96) si ottiene dall'equazione di stato.

Gli stati A e B si trovano su due diverse isoterme, una relativa alla temperatura di 500 K ed una (più bassa) relativa alla temperatura di 300 K: il gas si dilata a temperatura costante fino a raggiungere il volume dello stato B e poi si raffredda a volume costante.
Chiamiamo stato C lo stato intermedio.
| Stato del gas | volume | pressione | temperatura |
| A | VA = 50 dm3 | PA = 80 kPa | TA = 500 K |
| C | VC = 150 dm3 | PB = 26,7 kPa | TA = 500 K |
| B | VB = 150 dm3 | PB = 20 kPa | TB = 300 K |
Nell'isoterma AC il lavoro LAC fatto dal gas è uguale al calore acquistato QAC
LAC = QAC = n R T ln (VC/VA) = 8,76 J
Nell'isocora CB il lavoro è nullo e il al calore ceduto QCB vale:
QCB = cv n (TB - TC) = 2393,28 J
(in un gas monoatomico cv = 3/2 R)
Riassumiamo:| Trasformazione | Calore | Lavoro | ΔU = Q - L |
| isoterma AC | 8,76 J | 8,76 J | 0 |
| isocora CB | - 2 393,28 J | 0 | -2 393,28 J |
| trasformazione composta AB | - 2 384,52 J | 8,76 J | - 2 393,28 |
Si noti che, nei limiti delle approssimazioni di calcolo, il dato relativo alla variazione ΔU è identico a quello del problema precedente.
2) Ciclo rettangolare
| Stato del gas | volume | pressione | temperatura |
| A | VA = 50 dm3 | PA = 80 kPa | TA = 500 K |
| B | VB = 150 dm3 | PB = 80 kPa | TA = |
| C | VC = 150 dm3 | PC = 20 kPa | TC = |
| D | VD = 50 dm3 | PD = 20 kPa | TC = |
3) Bilancio energetico in un ciclo
Determina il lavoro eseguito dal gas nel ciclo.
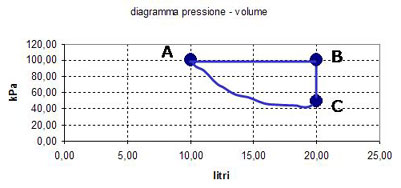
Mettiamo in una tabella le grandezze degli stati A, B, C del gas.
| Stato del gas | volume | pressione | temperatura |
| A | VA = 10 dm3 | PA = 100 kPa | TA = 300 K |
| B | VB = 20 dm3 | PB = 100 kPa | TA = 600 K |
| C | VC = 20 dm3 | PC = 50 kPa | TC = 300 K |
La trasformazione AB è una isobara e la temperatura varia proporzionalmente con il volume. La trasformazione BC è una isocora e la pressione varia proporzionalmente con la temperatura. La trasformazione CA è una isoterma e pressione e volume sono inversamente proporzionali.
Il lavoro compiuto durante il ciclo si ottiene sommando algebricamente il lavoro di ogni trasformazione:
Lciclo = LAB + LBC + LCA
LAB = pA (VB - VA) = 1000 J
LBC = 0
LCA = n R TA ln (VA/VC) = pA VA ln (VA/VC) = - 693 J
Lciclo = 1000 J - 693 J = 307 J
Il gas ha acquistato una quantità di calore QAB durante la dilatazione isobara, ha ceduto una quantità di calore QBC durante il raffreddamento a volume costante e infine ha ceduto un calore QCA nell'ultima isoterma. Per avere il calore totale, però, NON occorre fare i calcoli parziali.
Poichè in un ciclo la variazione di energia interna è nulla (Δ U = 0), si ha che, se il lavoro totale compiuto dal gas è Lciclo = 307 J anche la somma algebrica QAB + QBC + QCA = 307 J
| Indice | indietro | avanti |
Copyleft Ludovica Battista