| Indice | indietro | avanti |
Processi irreversibili

- Oscillazione di un pendolo
- Mescolamento delle carte da gioco
- Rimbalzo di una palla elastica
- Rimbalzo di una palla sgonfia
- Crescita di una pianta
- Dilatazione isoterma di un gas
- Espansione libera di un gas
- Passaggio di calore da un corpo caldo a uno freddo
Le trasformazioni fatte nell'ambiente di simulazione Gas perfetto sono compiute un passo alla volta con la possibilità di tornare indietro e ripercorrere la stessa strada al contrario. Nella realtà le trasformazioni sono reversibili solo se condotte molto lentamente per dare tempo al sistema di raggiungere tutti gli stati di equilibrio. Si parla di trasformazioni quasi statiche. Esse possono essere rappresentate, in un grafico, con una linea continua che unisce lo stato iniziale a quello finale.
Una trasformazione irreversibile non può essere rappresentata con una linea continua sul diagramma pressione-volume: ne possiamo indicare solo lo stato iniziale e lo stato finale.
Anche nella simulazione è possibile avere una trasformazione irreversibile: si sceglie la base isolante in modo da impedire scambi di calore tra sistema e ambiente e si varia la temperatura dell'ambiente in modo da creare una differenza di temperatura tra esterno e interno del cilindro. A questo punto, se si rimette la base conduttrice, il gas si dispone immediatamente in equilibrio termico con l'ambiente, variando anche il volume. Da questo stato non si torna indietro per la stessa strada (rimettendo la base isolante) alle condizioni precedenti. La trasformazione è irreversibile.
La prima legge della termodinamica è un modo di esprimere la legge di conservazione dell'energia, ma non dà nessuna informazione sulla reversibilità o meno di un fenomeno. Essa non vieta ad un gas che si è dilatato liberamente nel vuoto di ritornare indietro e non impedisce che ci sia un passaggio di calore da un corpo più freddo ad uno più caldo.
La seconda legge della termodinamica limita questa possibilità, introducendo un verso di percorrenza nell'evolversi di un fenomeno fisico. Una prima formulazione della seconda legge è:
Espansione libera

Questo tipo di trasformazione è detta espansione libera: senza la parete divisoria, il gas occupa tutto il volume a disposizione e quindi il volume aumenta.
Il gas si espande senza impiegare energia, cioè con lavoro nullo perchè lo spazio al di là della parete è vuoto e esso non incontra alcuna resistenza, inoltre il contenitore è isolato termicamente ed è nullo anche lo scambio termico.
Per il primo principio della termodinamica, l'energia interna del gas rimane costante e, in un gas perfetto, la costanza dell'energia interna implica la costanza della temperatura.
Questa trasformazione è spontanea e non reversibile: infatti non è possibile ripercorrerla al contrario rimettendo la parete divisoria. Come in tutte le trasformazioni irreversibili, i valori intermedi della temperatura, del volume e della pressione non sono definiti: in un diagramma pressione-volume possiamo solo tracciare lo stato iniziale e quello finale, ma non una linea continua che unisce tali stati: i due punti che rappresentano lo stato A e lo stato B sono su una isoterma, cioè su un ramo di iperbole, ma non possono essere collegati tra loro.
La pressione, come nelle isoterme, varia in modo inversamente proporzionale al volume: in questo caso il volume raddoppia e la pressione dimezza.
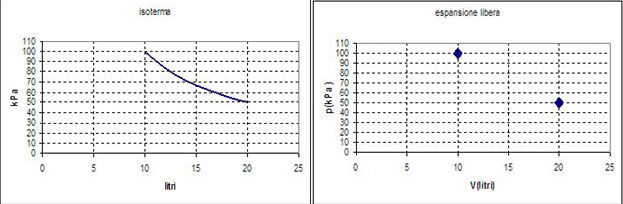
Tabella delle grandezze di stato
| Stato del gas | volume | pressione | temperatura |
| A | VA = 10 dm3 | PA = 100 kPa | TA = 300 K |
| B | VB = 20 dm3 | PB = 50 kPa | TB = 300 K |
| Indice | indietro | avanti |
Copyleft Ludovica Battista